孤立金属原理
孤立金属原理(又称孤立金属类比)是预测有机金属化合物键合性质的方法。在有机金属化学中,它将有机配体的结构与能与无机分子碎片结合的结构联系起来。罗尔德-霍夫曼将分子碎片描述为孤立的,"如果前沿轨道的数量、对称性、近似能量和形状以及其中的电子数是相似的--不是相同的,而是相似的"。如果两个分子碎片具有相似的前沿轨道、最高被占分子轨道(HOMO)和最低未被占分子轨道(LUMO),人们就可以从一个较不知名的碎片中预测其成键和反应性。isolobal化合物是等电子化合物的类似物,它们具有相同的价电子数和结构。图1是孤立分子结构的图形表示,孤立分子对通过双头箭头连接,下面有半条轨道,见图1。
由于在孤立分子类比方面的工作,霍夫曼于1981年获得了诺贝尔化学奖,他与福井健一分享了这一奖项。在他的诺贝尔奖演讲中,霍夫曼强调,孤立的类比是一个有用的,但简单的模型。在某些情况下,它确实失败了。
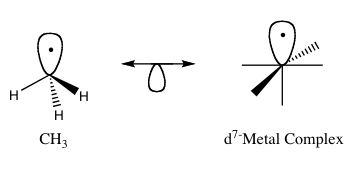
图1:隔离式类比的基本例子。
问题和答案
问:什么是 "孤立性原则"?答:隔离原理(又称隔离类比)是一种预测有机金属化合物结合特性的方法。它通过比较有机配体的最高占位分子轨道(HOMO)和最低未占位分子轨道(LUMO),将能与无机分子片段结合的有机配体结构联系起来。
问:谁提出了孤立的原则?
答:罗尔德-霍夫曼提出了孤立原则。
问:它与等电子化合物有什么关系?
答:Isolobal化合物是共享相同价电子数和结构的等电子化合物的类似物。
问:霍夫曼因其在这一概念上的工作获得了什么?
答:由于他在Isolobal类比方面的工作,霍夫曼在1981年被授予诺贝尔化学奖,他与福井健一共同获得了该奖项。
问:霍夫曼是如何描述分子碎片的?
答:霍夫曼将分子碎片描述为孤立的,"如果边界轨道的数量、对称性、近似能量和形状以及其中的电子数是相似的--不完全相同,但相似。"
问:人们如何使用这个模型来预测成键和反应性?
答:如果一个较不知名的物品有类似的前沿轨道,人们可以根据它们的前沿轨道预测它们的结合和反应性。
问:这个模型总是正确地工作吗?
答:不,它在某些情况下确实会失效。
搜索百科全书