过渡态
在一个化学反应中,过渡状态是有一个最大能量值的点。这个能量被称为活化能。当两个或更多的分子混合时,它们会互相撞击。如果它们撞击时有足够的能量通过过渡态,它们将发生反应并形成新的分子。在过渡状态,新的键形成,而旧的键被打破。在图形或图画中,过渡态通常用双匕首‡符号来标记。
研究过渡态是非常困难的。这是因为它的能量非常高,分子将在很短的时间内保持这种形式,通常是飞秒。重要的是,不要把过渡态和中间物混为一谈。中间体是在能量的最低点被发现的,它们可以存活很长的时间。然而,就像过渡态一样,中间物是在反应的试剂和产品之间。
研究过渡态对于理解反应机制非常重要。有一些理论和计算机程序可以用来计算过渡态的模样。这是化学动力学的一部分。
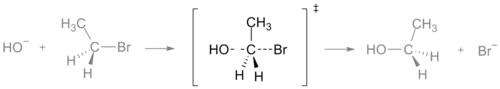
SN2反应的过渡状态
问题和答案
问:什么是化学反应中的过渡态?答:过渡态是化学反应中能量达到最大值的点。
问:什么是化学反应中的活化能?
答:反应发生所需的能量称为活化能。
问:当两个或两个以上的分子在化学反应中混合时会发生什么?
答:当两个或两个以上的分子混合时,它们会相互撞击。如果它们撞击的能量足以通过转变态,它们将发生反应并形成新的分子。
问:在化学反应的图表中,双匕首(‡)符号用来表示什么?
答:双匕首(‡)符号用于标记化学反应图或化学反应图中的过渡态。
问:为什么很难研究化学反应中的转变态?
答:研究化学反应中的转变态非常困难,因为转变态的能量非常高,分子停留在转变态的时间非常短,通常为飞秒。
问:什么是化学反应中的中间体?
答:中间体是在化学反应中能量最低点发现的分子,可以存活很长时间。
问:为什么研究过渡态对理解反应机理很重要?
答:研究过渡态对理解反应机理非常重要,因为它有助于确定反应是如何发生的,以及如何控制或操纵反应。
搜索百科全书