Π键
在化学中,∏键(π键)是一种电子的轨道与另一种电子的轨道交叉(重叠)的共价化学键。电子的路径呈叶形八字形(见图)。有两个重叠的区域,因为两个裂片上的路径是重叠的。只有一个轨道的结点平面通过两个相关核。
它们名字中的希腊字母π指的是p轨道。从键轴向下看,pi键的轨道对称性与p轨道看起来是一样的。p轨道通常有这种键。D轨道也被认为使用pi键,但现实中不一定是这样。d轨道成键的想法与超值理论相吻合。
Pi键通常比Sigma键弱。量子力学说,这是因为轨道路径是平行的,所以p轨道之间的重叠要少得多。
当两个原子轨道通过两个重叠区域接触时,就会发生π键。皮键是比西格玛键更分散的键。∏键中的电子有时被称为∏电子。由∏键连接的分子碎片如果不破坏∏键,就不能围绕该键旋转。旋转破坏了两个p轨道的平行路径。
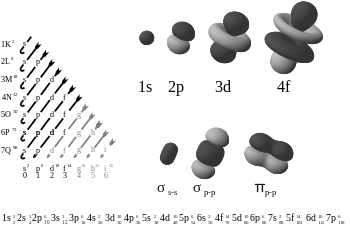
电子原子和分子轨道,在图片右下角显示一个pi键。

两个p-轨道形成一个π键。
多重债券
由双键连接的原子有一个西格玛键和一个π键。如果它们由三键连接,则有一个西格玛键和两个π键。
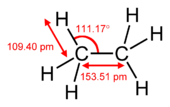
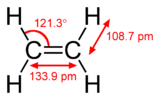
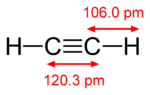
pi键比sigma键弱,但pi键和sigma键的组合比任何一个键本身都要强。多重键与单一键(西格玛键)的额外强度表现在很多方面。最明显的是键长的收缩。例如在有机化学中,碳-碳键长度在乙烷(154pm)、乙烯(134pm)和乙炔(120pm)。键数越多,总键越短,强度越大。电子构型以S、P、D、f-Block为基础。S有2个电子 P有6个电子 D有10个电子 F有14个电子。
|
|
|
|
| 乙烷 | 乙炔 |
特殊情况
Pi键不一定连接一对同样是sigma键的原子。
在某些金属络合物中,金属原子与炔、烯pi反键轨道之间的pi相互作用形成pi键。
在某些情况下,两个原子之间的多键,根本没有西格玛键,只有∏键。例如六羰基二铁(Fe2(CO)6)、二碳(C2)和硼烷B2H2。在这些化合物中,中心键只有∏键。为了获得最多的轨道重叠,键的距离比预期的短得多。
问题和答案
问:什么是化学中的π键?答:π键是一种共价化学键,其中一个电子的轨道路径与另一个电子的路径相交,由于路径在两叶上重叠,因此形成两个重叠区。
问:他们的名字中所指的希腊字母是什么?
答:他们名字中提到的希腊字母是π,它指的是p轨道。
问:π键的轨道对称性是什么?
答:π键的轨道对称性在沿着键轴看时与p轨道相同,因为p轨道通常有这种结合方式。
问:为什么π键通常比σ键弱?
答:π键通常比σ键弱,因为根据量子力学,轨道路径是平行的,所以p轨道之间的重叠要少得多。
问:π键何时发生?
答:π键发生在两个原子轨道通过两个重叠区域接触的时候。
问:什么是π键?
答:π键是比西格玛键更加分散的键。
问:由π键连接的分子片段能否围绕该键旋转而不破坏π键?
答:不能,由π键连接的分子片段在不破坏π键的情况下不能围绕该键旋转,因为旋转会破坏两个p轨道的平行路径。
搜索百科全书