原子轨道
原子轨道是原子核周围的电子在任何时候最可能出现的地方。它是一个数学函数,描述原子中一个电子或一对电子的波状行为。
之所以用"轨道"这个词,是因为人们认为电子的行为与太阳系相似,原子核像太阳,电子的轨道像行星。
一个元素的原子轨道数是由该元素所处的周期决定的。电子在轨道之间的移动取决于它们移动的速度和其他电子的数量。
在原子理论和量子力学中,原子轨道是一个量子数。每个这样的轨道可以由一个或两个电子占据。原子轨道的排列方式与原子的电子配置有关。它们来源于早期光谱学家对某些碱金属光谱线的描述,即为尖锐的、主要的、扩散的和基本的。
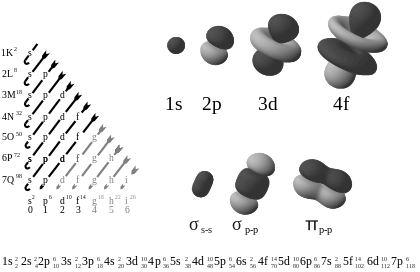
左图显示的是按能量增加顺序排列的轨道。右边是轨道形状的例子。
相关网页
- 电子云
- 分子轨道
问题和答案
问:什么是原子轨道?答:原子轨道是原子核周围最有可能找到电子的区域。
问:描述原子中电子行为的数学函数是什么?
答:描述原子中电子行为的数学函数是一个波状函数。
问:为什么要用 "轨道 "这个词?
答:"轨道 "一词是用来描述原子核周围最有可能发现电子的区域,因为人们曾经认为电子的行为就像行星绕着太阳运行。
问:如何定义一个元素的原子轨道数?
答:元素中的原子轨道数是由该元素的周期决定的。
问:为什么电子会在轨道间移动?
答:电子在轨道间移动取决于其速度和其他电子的数量。
问:什么是原子理论和量子力学中的原子轨道?
答:原子轨道是原子理论和量子力学中的一个量子数。
问:每个原子轨道可以被多少个电子占据?
答:每个原子轨道可以被一个或两个电子占据。
搜索百科全书