阿茲海默症
老年痴呆症(AD)是一种会慢慢破坏脑细胞的脑部疾病。截至目前,阿尔茨海默病还没有治愈的方法。随着时间的推移,该病的不同症状会越来越明显。很多人因为阿尔茨海默病而死亡。这种疾病会影响大脑的不同部位,但对大脑中控制记忆、语言和思维能力的区域影响最严重。老年痴呆症是最常见的老年痴呆症形式,占到70%的病例。
AD的临床症状通常发生在65岁以后,但大脑中不引起症状的变化,是由老年痴呆症引起的,可能在几年或某些情况下几十年前就开始了。虽然AD的症状在老年人中开始出现,但它并不是衰老的正常部分。
在这个时候有没有治愈阿尔茨海默氏症,但有治疗方法,可以帮助一些患者的迹象和症状,所以他们不会影响他们一样严重。还有一些治疗方法可以减缓疾病的发展,使大脑的损伤不会发生得那么快。还有某些个人习惯,人们可以学习,这可能有助于推迟疾病的发生。
虽然目前还不知道究竟是什么原因导致了阿尔茨海默病,但有一些风险因素可能会使一个人更有可能得到它。其中一些风险因素是遗传因素;已经发现四种不同基因的变化会增加风险。
目前,65岁的人一生中患老年痴呆症的风险估计为10.5%。它是美国第六大死亡原因,每年造成约83,500人死亡。2007年,全世界有超过2660万人受到阿尔茨海默病的影响。
阿尔茨海默病是以德国精神病学家和神经病理学家阿洛伊斯-阿尔茨海默的名字命名的,阿洛伊斯-阿尔茨海默是1906年在德国法兰克福一家医院研究了一位中年妇女奥古斯特-德特的病例后,首次描述了这种疾病。1910年,阿尔茨海默的同事Emil Kraepilin博士将此病命名为阿尔茨海默病。
缠结和匾额
在阿尔茨海默氏症患者的大脑中发现的两个主要特征是神经毛细血管缠结(简称"缠结"),它是由一种叫做tau的蛋白质组成的,以及衰老斑块(它主要是由另一种叫做β-淀粉样蛋白的蛋白质组成的,它们有时也叫做β-淀粉样蛋白束或简称"束")。形成束状物的tau蛋白之前将神经元内部的一种叫做微管的结构固定在一起,微管是神经元的重要组成部分,它构成了细胞骨架(细胞骨架)的一部分,而细胞骨架是维持细胞形状的,微管在细胞通讯中起到了一定的作用。
缠结和斑块都可能是由其他疾病引起的,如单纯疱疹病毒1型,该病毒正在被调查为发展为阿尔茨海默氏症的可能原因或贡献者。目前尚不清楚结节和斑块是否是导致阿尔茨海默氏症的原因之一,或者它们是否是结果。
微管 
微管是由一种叫做小管蛋白的蛋白质组成的。小管蛋白是聚合的,也就是分子反复形成相同的形状,这些形状的分子以基团的形式连接在一起,这些基团连接在一起。它们可以形成长链或其他形状;在这种情况下,聚合后的管蛋白形成微管。微管是像微观吸管一样的刚性管子,里面是中空的。微管有助于保持神经元的形状,并参与传递神经元的信号。
陶 
Tau是一种蛋白质,主要存在于中枢神经系统的神经元中。它们帮助将神经元内的微管连接在一起,当tau蛋白的工作方式发生变化时,微管就会破裂。tau蛋白不再将微管固定在一起,形成称为纤维的链,然后在神经元内聚集在一起,形成所谓的神经纤维缠结。这些结块,也被称为"tau tangles",是神经元死亡后剩下的所有东西。
| Braak 老年痴呆症相关神经纤维变化的分期。 | ||
| 阶段 | 神经纤维缠结在。 | 症状 |
| I/ | 经脑膜区和脑膜区。 | 无症状 |
| 三/ | 海马的形成以及边缘系统和杏仁核的部分内容。 | 初期阿尔茨海默氏病 |
| V/ | 在整个大脑皮层中 | 痴呆症:完全发展的阿尔茨海默氏症。 |
β-淀粉样蛋白 ![]()
β-淀粉样蛋白(Aβ)(又称"淀粉样蛋白β")斑块始于一种称为淀粉样蛋白前体蛋白(APP)的蛋白质。APP是构成细胞膜或外层覆盖物的蛋白质之一,可以保护细胞。在这种情况下,神经元...由于它是在细胞内制造的,APP通过细胞的膜伸出来。
在细胞的不同部位,包括细胞膜的最外层,被称为酶的化学物质将APP剪成小块。这些做剪断的酶是α-分泌酶、β-分泌酶和γ-分泌酶。根据哪种酶在做剪断以及APP的哪些部分被剪断,可能会发生两种不同的事情。一种是有益的,一种是导致β-淀粉样蛋白斑块的形成。
斑块的形成是由于β-淀粉样肽一端的APP分子被β-分泌酶剪断,从细胞中释放出sAPPβ。然后,γ-分泌酶在β-淀粉样肽的另一端剪断剩下的APP的碎片,并且,还从神经元的膜上伸出来。经过这次剪断,β-淀粉样肽被释放到神经元外的空间,并开始与其他β-淀粉样肽粘连。这些碎片粘在一起形成低聚物。现在不同大小的低聚物在神经元之间的空间里漂浮着,它们可能负责与邻近细胞和突触上的受体发生反应,影响它们的功能。
这些低聚物中的一部分会从大脑中清除。那些没有被清除掉的低聚物会与更多的β-淀粉样蛋白碎片聚集在一起。当更多的碎片聚集在一起时,低聚物就会越来越大,接下来的大小就叫原纤维,再往后的大小就叫纤维素。一段时间后,这些纤维素与其他蛋白分子、神经元和非神经细胞一起在细胞间的空间内漂浮,形成所谓的斑块。
脑淀粉样血管病(CAA)
β-淀粉样蛋白也会在大脑皮层和脑膜(脑膜是脑膜的两个内层--髓质和蛛网膜,是覆盖大脑的三层保护膜)的中小动脉(有时是静脉)的壁上(中层的tunica media和外层的tunica adventitia或tunica externa)形成沉积。
在60岁以上没有任何痴呆的人中,有30%的人发现CAA,但在90%-96%的阿尔茨海默病患者中发现CAA,其中三分之一到三分之二的人病情严重。
阶段
大脑中最先受到阿尔茨海默症影响的区域是"经颞叶区",它是位于大脑深处的颞叶内侧的一部分。这个区域的神经元首先开始死亡。然后蔓延到邻近的内脑皮层(EC),它作为一个中心枢纽,为一个广泛的网络处理记忆和运动的信号(就像一个主要的火车站,有通往不同区域的火车轨道)。
EC是海马和新皮质之间沟通的主要区域--新皮质是大脑的外部部分,负责更高的功能,如大脑如何感知来自五种感官的信息;(嗅觉、视觉、味觉、触觉和听觉;例如,看到一个人的脸并认出他们,)产生运动指令(例如,移动手臂或腿、走路、跑步)空间推理、意识思维和语言。
这种疾病就会蔓延到海马体,而海马体是边缘系统的一部分。海马体是大脑的一部分,参与形成新的记忆,组织它们,并将它们储存起来,以便日后回忆。它也是情感和感官,如嗅觉和声音与特定的记忆相连的地方。例子1:一个记忆可能会让你高兴或悲伤.例2.:一种气味可能会唤起某种记忆。
然后,海马体将记忆发送到大脑半球的不同部位,在那里它们被放置在长期的存储中,并在必要时帮助检索它们。举例来说。一个成年人试图记住一个幼儿园同学的名字。
除了处理记忆的海马体也参与情绪反应,导航(周围)和空间定位(知道你的地方感,因为你周围移动的例子。即使关了灯也能知道你在卧室里的路).)
其实海马体有两个部分,它的形状像一个马蹄铁,一个在大脑的左侧,另一个在大脑的右侧。
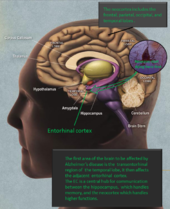
经颞叶区 ,颞叶内侧的一个狭窄区域首先受到阿尔茨海默病的影响,然后它就会蔓延到颞叶的旁边区域;内侧区域(或内侧皮层)。
诊断
临床前
红色 蓝色 绿色 紫色 橙色
紫色 橙色 绿色 蓝色 红色
蓝色 橙色 紫色 绿色 红色
紫色 绿色 红色 蓝色 橙色
斯特罗普色彩词汇测试
这是一个简短的测试例子。该测试用于测量不同的认知功能,如选择性注意。
命名第一组单词的颜色比第二组更容易、更快捷,因为在第一组中,颜色与单词相匹配,在第二组中则不匹配。所以人要多注意。
早期阿尔茨海默氏症患者的注意力有问题,往往在这项测试中表现不佳。
随着目前利用神经影像学的进步,如FDG-PET和PIB-PET扫描,以及脑脊液(CSF)检测的研究,现在有可能检测到阿尔茨海默病的开始过程,这些过程发生在症状开始之前。研究表明,临床上正常的老年人(完全没有症状)有淀粉样蛋白β(Aβ)在大脑中堆积的生物标志物证据。这种淀粉样蛋白 beta (Aβ) 与大脑结构的变化有关,以及它如何工作,是类似于在轻度认知障碍 (MCI) 的人中看到的东西--这可能导致阿尔茨海默氏症--和阿尔茨海默氏症的人。
这些小的临床前的变化(没有症状)在大脑中可能会发生很多年,甚至几十年前一个人被诊断为阿尔茨海默氏症。与阶段,有一些记忆力下降,或轻度认知障碍。这些变化使人有可能出现全面的阿尔茨海默氏症的临床症状,但不是每个有这些变化的人都会得病。即使没有治愈阿尔茨海默氏症的方法,也有一些新的治疗方法正在开发中,在疾病的最初阶段会有更好的效果。
目前究竟是什么构成了阿尔茨海默氏症的临床前阶段,仍在研究中,比如为什么有些人与继续发展为阿尔茨海默氏症,而有些人则没有。所以临床前阶段这个词只用于研究。在世界范围内,各国都在努力做这方面的研究,称为世界范围内的阿尔茨海默病神经影像学计划(WW-ADNI),它是通过北美ADNI、欧洲ADNI(E-ADNI)、日本ADNI、澳大利亚ADNI(AIBL)、台湾ADNI、韩国ADNI、中国ADNI和阿根廷ADNI进行神经影像学研究的总组织。
初始阶段
"在阿尔茨海默氏症的非常早期阶段的误诊是一个重要的问题,因为有超过100种情况可以模仿这种疾病。在有轻微记忆抱怨的人中,我们的准确性几乎不比偶然性好。"研究研究员、杜克医学院精神病学和医学教授P.Murali Doraiswamy,MBBS称,"鉴于诊断阿尔茨海默氏症的最终金标准是尸检,我们需要一种更好的方法来研究大脑。"
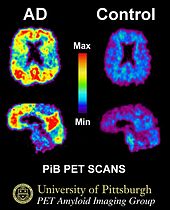
这种PiB-PET扫描显示,阿尔茨海默氏症患者的大脑中存在大量淀粉样蛋白β(Aβ)。Pib代表匹兹堡化合物B(PiB),它是一种染料,在扫描前注入人体内。淀粉样β会吸收PiB;当PET扫描完成后,有Pib的区域会发出荧光(发光)PiB-PET扫描现在被用于研究检测临床前阶段(在出现任何症状之前)的淀粉样β(Aβ)。
历程
1901年,一位名叫Auguste Deter的51岁妇女被送进位于德国美因河畔法兰克福的城市精神病和癫痫病人收容所,该收容所有一个绰号叫"Irrenschloss"(疯人城堡)。她结过婚,生活正常,直到结婚前8个月,她开始出现心理和神经问题,如记忆和语言问题、妄想症、迷失方向和出现幻觉。
一位名叫阿洛伊斯-阿尔茨海默(1864-1915年)的医生对她进行了研究。阿尔茨海默之所以对她的病例感兴趣,是因为她的年龄;虽然当时已经知道老年痴呆症的影响,但通常要等到一个人在60岁早期到中期才开始。她的案例也值得注意,因为痴呆症的发病速度很快,从报告第一次出现症状到她被送进医院只有八个月。
在对Deter女士进行一次检查时,他要求她完成一系列简单的写作任务。她无法完成要求的任务,如写自己的名字,就说"我可以说是迷失了自己"("Ich habe mich sozusagen selbst verloren")。
1902年阿尔茨海默离开了弗兰夫库尔特的医院,开始与埃米尔-克拉佩林在海德堡-伯格海姆的精神病大学医院工作,1903年他和克拉佩林都开始在慕尼黑的路德维希-马克西米利安大学工作。
1906年4月8日德特女士死于败血症,阿尔茨海默得知后,将她的大脑送往慕尼黑让他研究。在显微镜下研究她的大脑样本时,他注意到了由β-淀粉样斑块组成的神经纤维素缠结和束,这是疾病的两个主要特征。1906年11月3日,阿尔茨海默在图宾根召开的德国西南部精神病学家会议上介绍了他对奥古斯特病例的研究结果,并于1907年发表了他对该病例的研究成果。
1910年,Emil Kraepelin将这种疾病命名为"阿尔茨海默病"。老年痴呆症通常beigins影响60-65岁之间的人,在Deter女士的情况下--她死的时候是55岁--她有一种现在被称为早发性阿尔茨海默氏病的形式。

"Irrenschloss" (疯人堡) 就在德国美因河畔法兰克福的城市精神病和癫痫病人收容所,奥古斯特-德特在51岁时被送进了那里,此时她的症状才开始8个月。她是第一个被诊断出患有现在所谓的阿尔茨海默病的人,在她的案例中,她是早期发病的类型。
著名案例
任何人都有可能得老年痴呆症,有钱人或贫穷的名人和不知名的人。得过阿尔茨海默病的名人有美国前总统罗纳德-里根和爱尔兰作家艾里斯-默多克,他们都是科学文章的研究对象,研究他们的认知能力如何随着疾病而恶化。
演员查尔顿-赫斯顿和吉恩-怀尔德、小说家特里-普拉切特、政治家和活动家萨金特-施莱弗、蓝调音乐家B.B.金、导演雅克-里维特、印度政治家乔治-费尔南德斯、2009年诺贝尔物理学奖获得者查尔斯-K.高。2012年,诺贝尔奖作家加布里埃尔-加西亚-马尔克斯被诊断出患有此病。2017年5月,芬兰前总统Mauno Koivisto因病去世。乡村歌手格伦-坎贝尔于2017年8月死于该病。

罗纳德-里根患老年痴呆症10年了
问题和答案
问:什么是阿尔茨海默病?答:阿尔茨海默病(AD)是一种缓慢破坏脑细胞的脑部疾病,目前尚无治愈方法。它影响到大脑的不同部分,特别是控制记忆、语言和思维能力的部分。
问:阿尔茨海默病有多常见?
答:阿尔茨海默氏病是最常见的老年痴呆症,占70%的病例。目前,一个65岁的人一生中患阿尔茨海默病的风险估计为10.5%。2007年,全世界有超过2660万人受到阿尔茨海默病的影响。
问:阿尔茨海默病是否有治疗方法?
答:虽然阿尔茨海默病无法治愈,但有一些治疗方法可以帮助一些患者消除症状,使其不至于受到严重影响。也有一些治疗方法可以延缓疾病的发展,使大脑的损害不那么快发生。人们还可以学习某些个人习惯,这些习惯可能有助于推迟疾病的发生。
问:谁发现了阿尔茨海默病?
答:该病是以德国精神病学家和神经病理学家阿洛伊斯-阿尔茨海默的名字命名的,他于1906年在德国法兰克福研究了一名病人后首次描述了该病。1910年,阿洛伊斯的同事埃米尔-克雷皮林博士将该病命名为 "阿尔茨海默病"。
问:哪些是与患AD有关的风险因素?
答:一些与AD有关的风险因素包括遗传变化;已经发现有四种不同的基因会增加一个人的患病风险。年龄是另一个因素;临床症状通常发生在65岁以后,但AD引起的大脑变化可能在那之前几年甚至几十年就开始了。
问:老年人患这种类型的痴呆症是否正常?
答:不是--尽管症状通常开始于老年人,但它不被认为是正常衰老过程的一部分,如果在老年人或家庭成员/朋友身上发现,不应认为是这样。
搜索百科全书






-MRI.png)



