螯变反应
Cheletropic反应是一种周环反应,其中一个试剂上的一个原子得到两个新的键。周环反应是一个涉及过渡态的反应,它有一个原子的循环阵列和相关的相互作用轨道的循环阵列。σ和π键的重组发生在这个环形阵列中。
螯合反应是环化反应的一个子类。螯合反应的不同之处在于,在其中一个试剂上,两个新键都是在同一个原子上进行的。图1中的右边显示了几个例子。在第一种情况下,单一原子是羰基中的碳原子。这个碳原子最后变成了一氧化碳。最终的结果是与一个原子形成两个新的键。前两个例子被称为 "螯合挤压",因为在反应中会放出一个稳定的小分子。这些反应的驱动力往往是释放气体(如CO或N2)的熵值。
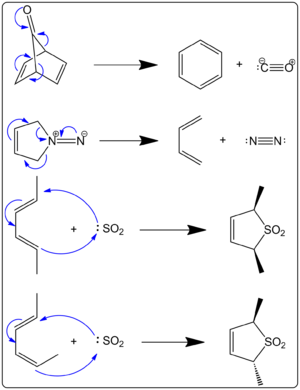
图1.过环反应
理论分析
由于参与螯合反应的分子的几何形状,它们证实了理论化学家的一些预测。螯合反应证实了分子轨道对称性的保存。
在围环过渡态中,一个小分子向环捐赠了两个电子。有两种可能的几何形状可以解释这一反应。小分子可以以线性或非线性的方式接近。在线性方式中,小分子的轨道上的电子直接指向大分子的π系统。在非线性方法中,轨道以一个略微偏离的角度接近。当小分子接近时,π系统的旋转能力对于形成新的键至关重要。旋转的方向将取决于系统中有多少个π电子而有所不同。下面是一个使用前沿分子轨道的两电子碎片接近四电子π系统的图示。如果小分子是线性接近,旋转将是离旋的,如果分子是非线性接近,旋转将是顺旋的。脱转和顺转告诉我们π系统中的键是如何旋转的。异向旋转意味着方向相反,而同向旋转意味着方向相同。这也显示在下图中。
使用Huckel规则,我们可以知道π系统是芳香族还是反芳香族。如果是芳香族,线性方法使用离旋运动,而非线性方法使用顺旋运动。反芳烃系统则相反。线性方法将有顺转运动,而非线性方法将有逆转运动。
涉及SO的螯合反应2
热力学
当二氧化硫与丁二烯和异戊二烯反应时,会产生两种不同的产品。反应机理将控制生成什么。一个动力学产物和一个热力学产物都是可能的。热力学产物比动力学产物产生得更多。动力学产物来自Diels-Alder反应,而cheletropic反应会产生一个热力学上更稳定的产物。cheletropic途径被更多地使用,因为它能产生更稳定的五元环加合物。下面的方案显示了这两种产品之间的区别。左边的路径显示热力学产物,而右边的路径显示动力学产物。苏亚雷斯和索尔多在1995年展示了这一点。他们通过实验和使用高斯计算显示了这一点。
动力学
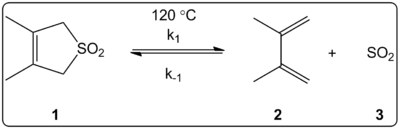
这方面的一个例子是1,3-二烯与二氧化硫的螯合反应。化学家们仔细研究了这种反应的动力学。1976年,Isaacs和Laila测量了二氧化硫添加到丁二烯衍生物中的动力学因素。在30℃的苯中,在最初的20倍过量的二烯中监测添加率。他们使用分光光度计在320纳米处研究光,以测量SO2的消失。该反应显示出 "伪一阶动力学"。化学家们发现,二烯上的吸电子基团降低了反应速率。此外,反应速度还受到2-取代物的立体效应的很大影响,更多的笨重基团会增加反应速度。(换句话说,悬挂在第二个碳原子上的原子组越大,反应就越快)。作者将此归因于笨重基团有利于二烯的顺式构象,这对反应至关重要(见下表)。此外,还测量了七种二烯在四个温度下的速率。根据这些测量结果,化学家们使用阿伦纽斯方程来计算每个反应的活化焓(ΔH‡)和活化熵(ΔS‡)。这是研究螯合反应健力宝的第一批重要工作之一。
| -丁二烯 | 104k /min−1 (30 °C) (± 1-2%) 绝对值 | 104k/min−1 (30 °C) (± 1-2%) 相对 | ΔH ‡/kcal mol−1 | ΔS ‡/cal mol−1 K −1 |
| 2-甲基 | 1.83 | 1.00 | 14.9 | -15 |
| 2-乙基 | 4.76 | 2.60 | 10.6 | -20 |
| 2-异丙基 | 13.0 | 7.38 | 12.5 | -17 |
| 2-叔丁基 | 38.2 | 20.8 | 10.0 | -19 |
| 2-新戊基 | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | 不适用 | 不适用 |
| 2-溴乙基 | 0.72 | 0.39 | 不适用 | 不适用 |
| 2-pol-tolyl | 24.7 | 13.5 | 10.4 | -19 |
| 2-苯基 | 17.3 | 9.45 | 不适用 | 不适用 |
| 2-(对溴苯基) | 9.07 | 4.96 | 不适用 | 不适用 |
| 2,3-二甲基 | 3.54 | 1.93 | 12.3 | -18 |
| 顺式-1-甲基 | 0.18 | 0.10 | 不适用 | 不适用 |
| 反式-1-甲基 | 0.69 | 0.38 | 不适用 | 不适用 |
| 1,2-二甲苯-环己烷 | 24.7 | 13.5 | 11.4 | -16 |
| 2-甲基-1,1,4,4-d4 | 1.96 | 不适用 | 不适用 | 不适用 |
Monnat、Vogel和Sordo在2002年测量了二氧化硫添加到1,2-二甲基环烷的动力学。他们写道,1,2-二甲基亚甲基环己烷与二氧化硫的反应可以得到两种不同的产物,这取决于反应条件。在动力学控制下(≤-60℃),该反应通过杂二els-Alder反应生成相应的苏氨酸,但在热力学控制下(≥-40℃),该反应通过cheletropic反应生成相应的亚砜。杂二els-Alder反应的活化焓比相应的cheletropic反应的活化焓小2千卡/摩尔。在2CHCl2/SO2溶液中,该亚砜比等量的苏氨酸稳定约10千卡/摩尔。
作者能够通过实验得出1,2-亚甲基环己烷与二氧化硫的反应在261.2K下的速率规律,从而得到相应的亚砜。该反应在1,2-亚甲基环己烷中是一阶,但在二氧化硫中是二阶(见下文)。这证实了理论化学家们基于高水平的ab initio量子计算所做的预测。利用计算方法,作者提出了1,2-亚甲基环己烷与二氧化硫的螯合反应的过渡结构(见右图)。该反应在二氧化硫中是二阶的,因为另一个二氧化硫分子可能与过渡态结合以帮助稳定它。Suarez、Sordo和Sordo在1995年的一项研究中也发现了类似的结果,该研究使用ab initio计算来研究二氧化硫与1,3-二烯反应的动力学和热力学控制。
d [ ] 3d t = k [ 2]1 [ S O ] {\22displaystyle {frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}。
溶剂效应
在14种溶剂中对3,4-二甲基-2,5-二氢噻吩-1,1-二氧化物(如右图所示)的螯合反应的溶剂的影响进行了动力学研究。发现正向和反向反应的反应速率常数以及平衡常数与ET(30)溶剂极性尺度呈线性相关。
反应在120℃下进行,并通过反应混合物的1H-NMR光谱进行研究。发现正向速率k在从1环己烷到甲醇的过程中减少了4.5倍。反向速率k-1被发现从环己烷到甲醇增加了53倍,而平衡常数Keq下降了140倍。有人认为,在活化过程中,极性发生了变化,平衡和动力学数据之间的关系证明了这一点。作者说,反应似乎受到了溶剂极性的影响,这可以通过从反应物到过渡态再到产物时偶极矩的变化来证明。作者还说,螯合反应似乎不受溶剂酸度或碱度的影响。
这项研究的结果使作者预期会出现以下行为。
1.溶剂极性的变化对速率的影响将小于平衡。
2.速率常数的特点是对极性的影响相反:k1会随着E(T30)的增加而略微下降,而在相同条件下k-1会增加。
3.对k的影响-1会比对k1的影响大。
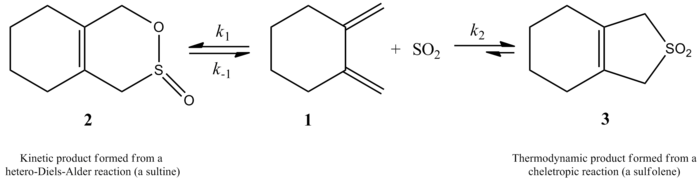
1,2-二甲基环已烷与SO2的反应在动力学控制下通过异型二els-Alder反应得到苏尔坦,或在热力学控制下通过Cheletropic反应得到亚磺酰。
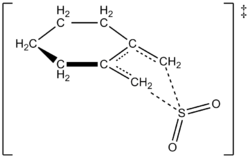
1,2-亚甲基环己烷与SO2通过螯合反应生成亚磺酸盐的过渡状态的建议
在各种溶剂中研究螯合剂反应
烯烃的碳化物加成
在合成上最重要的螯合反应之一是将一个单质碳化物加入到一个烯烃中,制成一个环丙烷(见左图)。碳烯是一种中性分子,含有一个二价碳,其价壳中有六个电子。正因为如此,碳化物是高度反应性的亲电体,并作为反应中间体生成。一个单质碳化物包含一个空的p轨道和一个大约有两个电子的sp2混合轨道。单质碳化物与烯烃的加成是立体的,环丙烷的产物中保留了烯烃的立体化学性质。碳烯加入烯烃的机制是协同[2+1]环加成(见图)。来自氯仿或溴仿的碳化物可以用来向烯烃添加CX2,从而得到二卤代环丙烷,而Simmons-Smith试剂添加CH2。
填充的碳烯轨道与烯烃π系统的相互作用产生了一个四电子系统,有利于非线性方法。将碳烯的空p轨道与填充的烯烃π轨道混合也是有利的。有利的混合是通过非线性方法进行的(见右图2)。然而,虽然理论上明显倾向于非线性方法,但对于线性与非线性方法并没有明显的实验意义。
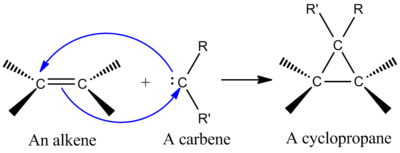
卡宾与烯烃相加形成环丙烷
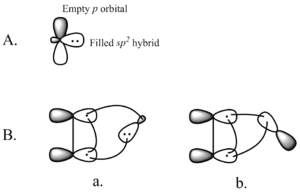
图2.A) 单子碳化物的轨道 B) a) 碳化物sp2轨道和b) 碳化物p轨道的非线性方法
问题和答案
问:什么是干酪反应?答:螯合反应是一种过环反应,其中一个试剂上的一个原子得到两个新的键。
问:什么是过环反应?
答:过环反应是指涉及一个具有原子循环阵列和相关的相互作用轨道循环阵列的过渡态的反应,在这个过渡态中,存在着َ和ً键的重组。
问:它与其他类型的反应有什么不同?
答:螯合反应是环加成的一个子类,它与其他类型的反应不同之处在于,在其中一个试剂上,两个新键都是在同一个原子上进行的。
问:有哪些例子?
答:例子包括 "螯合挤压",如羰基中的单原子最后变成了一氧化碳。
问:是什么驱动这些反应?
答:这些反应的驱动力往往是释放气体(如CO或N2)的熵值。
问:图1与螯合反应有关吗?答:是的,图1显示了螯合反应的例子。
搜索百科全书
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)