Σ迁移反应
有机化学中的对数反应是一种过环反应。sigmatropic反应不使用催化剂,只涉及一个分子(非催化的分子内过程)。它将一个σ键变为不同的σ键。sigmatropic这个名称是由长期以来确立的单碳碳键的"sigma"名称和希腊语"tropos"(意为转折)复合而成的。这是一种重排反应,意思是分子中的键在原子之间发生了转移,而没有任何原子离开或新的原子加入到分子中。在sigmatropic反应中,在分子内反应中,一个取代基从π键体系的一部分移动到另一部分,同时π体系发生重排。真正的同位素反应通常不需要催化剂。有些同位素反应是由路易斯酸催化的。对数反应通常有过渡金属催化剂,在类似反应中形成中间体。最著名的同位素重排有[3,3]科普重排、Claisen重排、Carroll重排和Fischer吲哚合成。
Sigmatropic Shifts概述
伍德沃德-霍夫曼标志移位命名法(Woodward-Hoffman Sigmatropic Shift Nomenclature)
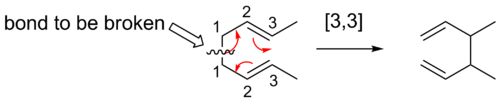
用一种特殊的符号来描述sigmatropic shifts。分子主干上的每个碳原子都有一个位置号。对数重排用一个顺序项[i,j]来描述。这意味着与一个或多个π系相邻的σ键迁移到一个新的位置(i-1)和(j-1)原子,从σ键的原始位置移走。当i和j之和为偶数时,表明有一个中性的全C原子链参与。奇数则表明有一个带电的C原子或一个杂原子孤对取代了碳碳双键。因此,[1,5]和[3,3]移位变成[1,4]和[2,3]移位与杂原子,同时保留对称性考虑。为了清楚起见,第三个例子中省略了氢。

这里有一种方法可以找到给定的同位素重排的顺序。第一步是给每个原子赋予数字,从被破坏的键的原子作为原子1开始,化学家从被破坏的键到生成物中形成新的σ键的原子,每个方向都要数。然后将形成新键的原子对应的数字用逗号隔开,并置于括号内。这样就形成了对位反应顺序描述符。
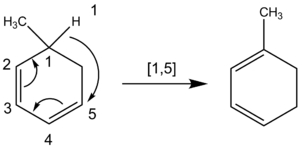
化学家在命名氢原子移动的sigmatropic移位时,也会计算原子。氢原子迁移时,碳链不会断裂。所以,化学家在反应中对所有参与反应的原子进行计数,而不是只对最接近的原子进行计数。例如,下面的氢原子迁移的顺序是[1,5],是通过逆时针方向计数通过π系统达到的,而不是通过环CH2基团的[1,3]顺序,如果顺时针方向计数,就会产生错误的结果。
面上和反面的变化
化学家们研究了迁移基团具有立体中心的sigmatropic反应。原则上,所有的对位转移都可以在迁移基团的几何形状相同(保留)或相反(反转)的情况下发生。这取决于是用迁移原子的原键叶还是用它的另一键叶来形成新的键。
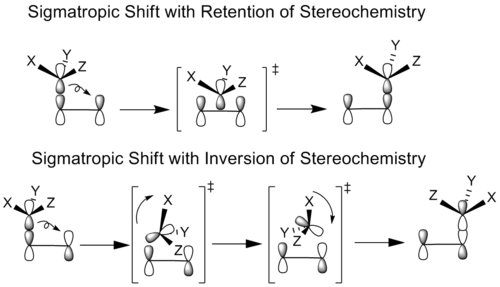
在立体化学保留的情况下,迁移基团不经旋转就转化到成键位置。在立体化学反转的情况下,迁移基团既旋转又转化,以达到其成键构型。
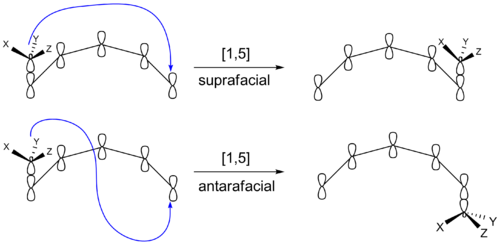
还有一种方式是,同位素反应可以产生不同立体化学的产物。迁移的基团在重新结合后可以留在π系的原面。或者,它也可以到π体系的相反面。如果迁移基团仍停留在π系统的同一面,则称为上面转移。如果迁移组转移到对侧面则称为反面转移。发生在中小环内的转变不能进行反面转变。
Sigmatropic Rearrangements的种类
[1,3]轮班
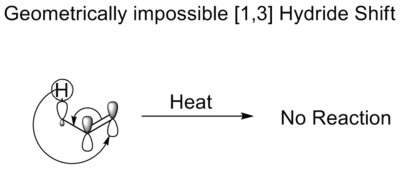
热氢化物转变
在热[1,3]氢化物转变中,一个氢化物会移动三个原子。根据Woodward-Hoffmann规则,它将以反面移动的方式进行。虽然这样的转变是对称性允许的,但过渡态中所要求的莫比乌斯拓扑结构禁止这样的转变。这在几何学上是不可能的。这就是为什么烯醇在没有酸或碱催化剂的情况下不会发生异构化的原因。
烷基热转变
热烷基[1,3]转变,类似于[1,3]氢化物转变,必须反面进行。过渡态的几何形状是禁止的。但烷基基团由于其轨道的性质,可以颠倒其几何形状,与sp3轨道的后叶形成新的键。这种反应将导致超面移。由于过渡态的高度有序性,这些反应在开链体系中仍不常见。所以,这些反应在环状分子中效果更好。
![[1,3] Alkyl Shifts](https://www.alegsaonline.com/image/550px-1,3alkylfixed.png)
光化学[1,3]转变。
光化学[1,3]位移应该是超面位移;然而,大多数是不协调的,因为它们是通过三态进行的(也就是说,它们有一个二价机制,伍德沃德-霍夫曼规则不适用)。
[1,5]班
[1,5]转变涉及π体系中1个取代基(-H、-R或-Ar)向下5个原子的转变。已有证据表明,在200˚C或以上的温度下,氢在环链和开链体系中都会发生转移。据预测,这些反应是通过Huckel-topology过渡状态进行的。
![[1,5] Hydride shift in a cyclic system](https://www.alegsaonline.com/image/300px-1,5hydridecyclicfixed.png)
光辐照需要氢的反面移动。虽然这种反应很少,但也有一些例子表明,反面移动是有利的。
![Antarafacial [1,5] Hydride Shift](https://www.alegsaonline.com/image/600px-1,5hantarafacialfixed.png)
与氢[1,5]转移相反,在开链体系中从未观察到任何[1,5]烷基转移。化学家们已经确定了[1,5]烷基在环状体系中的速率偏好:羰基和羧基>氢化物>苯基和乙烯基>>烷基。
烷基基团发生[1,5]位移的情况非常差,通常需要高温。然而,对于环己二烯来说,烷基移位的温度并不比迁移性最好的羰基高多少。一项研究表明,这是因为环己二烯上的烷基移位是通过不同的机制进行的。首先是开环,接着是[1,7]移位,然后环上进行电环改革。
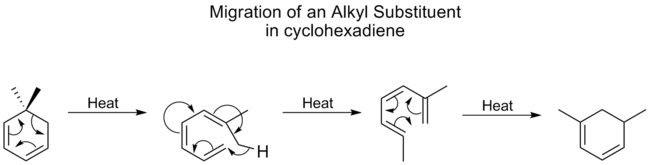
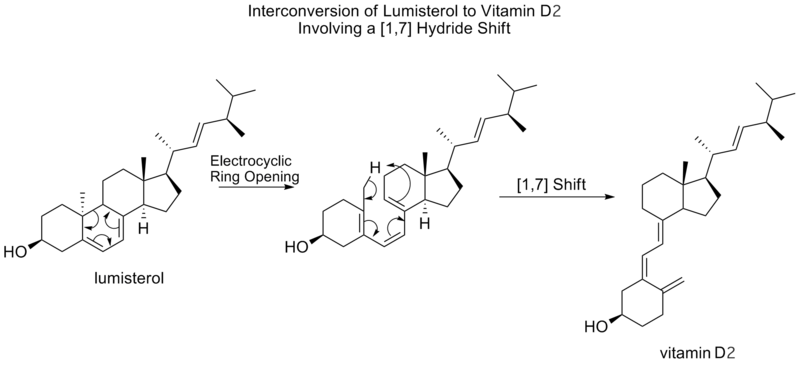
下面可以看到这一相同的机理过程,但没有最后的电环闭合反应,在鲁米斯特罗与维生素D2的相互转化中,也是如此。
[1,7] 轮班
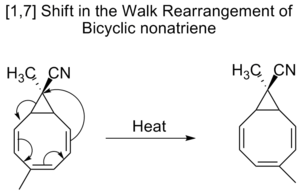
伍德沃德-霍夫曼规则预测,[1,7]相变是通过莫比乌斯拓扑过渡状态以反面方式进行的。在鲁米斯特罗转化为维生素D2的过程中,观察到一个反面的[1,7]转变,在电环开环到维生素D2之后,一个甲基氢发生了转变。
双环壬三烯也会发生[1,7]移位,即所谓的walk重排,即二价基团的移位,作为三成员环的一部分,在双环分子中。
[3,3] 轮班
3,3]的形变是很好研究的形变重排。伍德沃德-霍夫曼规则预言,这六个电子反应将采用Huckel拓扑过渡态进行超平面反应。
克莱森重新安排
1912年由Rainer Ludwig Claisen发现,Claisen重排是有记录的第一个[3,3]-sigmatropic重排的例子。这种重排是一种有用的碳-碳成键反应。Claisen重排的一个例子是烯丙基乙烯基醚的[3,3]重排,加热后产生一个γ,δ-不饱和羰基。羰基的形成使这一反应与其他sigmatropic重排不同,本质上是不可逆的。

芳香族克莱森重排
正构-Claisen重排涉及烯丙基苯基醚的[3,3]转变为中间物,该中间物迅速同构为正构苯酚。
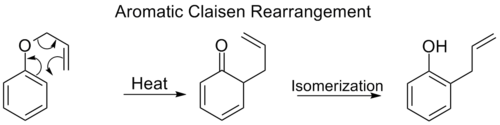
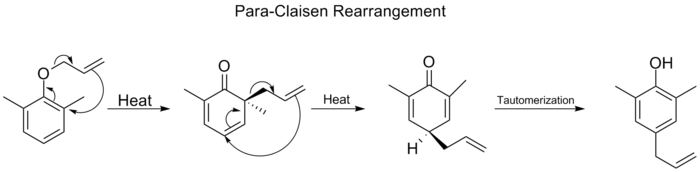
当苯环上的两个对位都被阻断时,将发生第二次对位-Claisen重排。这种对位-Claisen重排以同分异构化为三取代酚结束。
科普重排
Cope重排是一种广泛研究的有机反应,涉及1,5-二烯的[3,3]对位重排。它是由Arthur C. Cope开发的。例如,3,4-二甲基-1,5-己二烯加热到300℃可生成2,6-辛二烯。

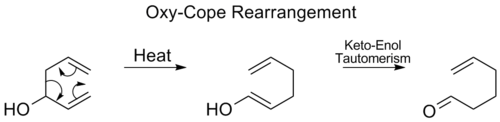
Oxy-Cope重排
Oxy-Cope重排在C3处加入一个羟基,形成中间烯醇的酮-烯醇同构后的烯醛或烯酮。
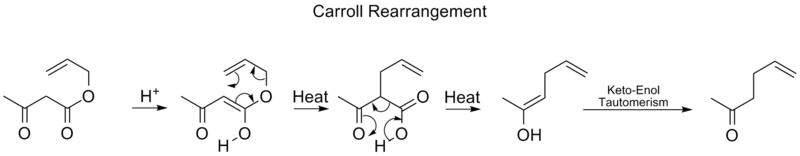
Carroll重新安排
卡罗尔重排是有机化学中的一种重排反应,涉及β-酮烯丙基酯转变为α-烯丙基-β-酮羧酸。该有机反应后可进行脱羧,最终产物为γ,δ-烯丙基酮。Carroll重排是Claisen重排的改编,实际上是一种脱羧烯丙基化。
菲舍尔吲哚的合成
费舍尔吲哚合成是在酸性条件下,由(取代的)苯肼和醛或酮生成芳香杂环吲哚的化学反应。该反应由Hermann Emil Fischer于1883年发现。
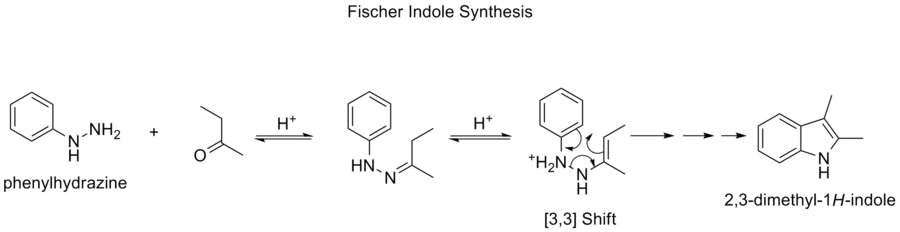
酸性催化剂的选择非常重要。成功的酸催化剂包括:布朗斯特酸,如HCl、H2SO4、聚磷酸和对甲苯磺酸。三氟化硼、氯化锌、氯化铁和氯化铝等路易斯酸也是有用的催化剂。
已经发表了几篇评论。
[5,5]轮班
与[3,3]移位类似,Woodward-Hoffman规则预测[5,5]同位素移位将进行超平面的Huckel拓扑过渡状态。这些反应比[3,3]sigmatropic移位更罕见,但这主要是由于能发生[5,5]移位的分子比能发生[3,3]移位的分子更罕见。
![[5,5] shift of phenyl pentadienyl ether](https://www.alegsaonline.com/image/800px-5,5shiftfixeds.png)
步行重新安排
二价基团,如O、S、NR或CR2等二价基团在双环分子中作为三成员环的一部分,其迁移通常被称为走位重排。这可以根据Woodward-Hofmann规则正式表征为(1,n)sigmatropic移位。这种重排的一个例子是托品亚基(1,3,5-环庚三烯)上的取代基的移位。当加热时,pi系经过电环闭合形成双[4,1,0]庚二烯(norcaradiene)。此后跟着[1,5]烷基的转变和电环开环。
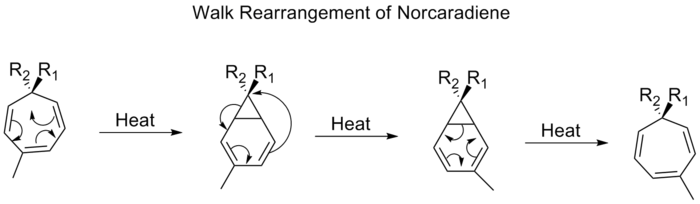
通过[1,5]转变,预计去甲碳二烯的步行重排将在保留立体化学的情况下进行。然而,实验观察表明,去甲芳香烃的1,5-移位是反面进行的。理论计算发现[1,5]转变是一个二价过程,但不涉及势能表面的任何二价最小值。
相关网页
- 2,3-同位素重排。
- NIH shift
- 前沿分子轨道理论
- Woodward-Hoffmann规则
问题和答案
问:什么是有机化学中的变位反应?答:对称反应是指涉及非催化的分子内过程的围环反应,并将一个σ键变为另一个σ键。
问:异相反应是否涉及催化剂?
答:一个实际的拟态反应通常不涉及催化剂,尽管一些拟态反应可以由路易斯酸催化。
问:"拟态 "一词是什么意思?
答:"拟态 "一词是一个复合词,由 "西格玛 "和希腊语 "特罗普斯 "组成,前者指的是单碳-碳键,后者指的是转动。
问:什么样的反应是异相反应?
答:同位素反应是一种重排反应,意思是分子中的键在原子之间移动,没有任何原子离开或新原子加入分子。
问:在分子内同位素反应中会发生什么?
答:在分子内同位素反应中,一个取代基从π键系统的一个部分移到另一个部分,同时π键系统重新排列。
问:有什么著名的同位素重排吗?
答:一些最著名的示踪重排是[3,3]Cope重排、Claisen重排、Carroll重排和Fischer吲哚合成。
问:同位素反应是否经常涉及过渡金属催化剂?
答:是的,类比反应经常有过渡金属催化剂,在类比反应中形成中间产物。
搜索百科全书